H₂SO₄ là gì?
H₂SO₄ hay axit sunfuric là một hợp chất hóa học vô cơ có công thức phân tử H₂SO₄, được xem là một trong những axit mạnh và quan trọng nhất trong công nghiệp hóa chất. Ở điều kiện thường, axit sunfuric là chất lỏng không màu, sánh, không mùi, có khả năng hút ẩm mạnh và gây ăn mòn cao. H₂SO₄ có tính axit mạnh, tính oxi hóa và đặc biệt là tính háo nước, nên được ứng dụng rộng rãi trong sản xuất phân bón, pin hay ắc quy, xử lý kim loại, chế biến dầu mỏ và nhiều ngành công nghiệp khác. Đây cũng là hóa chất đóng vai trò “huyết mạch” trong công nghiệp, dùng để đánh giá trình độ phát triển công nghiệp của một quốc gia.

Cấu tạo phân tử H₂SO₄
Phân tử H₂SO₄ gồm một nguyên tử lưu huỳnh (S) liên kết với bốn nguyên tử oxy (O) và hai nguyên tử hiđro (H). Trong đó, lưu huỳnh nằm ở trung tâm, tạo hai liên kết đôi với hai nguyên tử oxy, và hai liên kết đơn với hai nhóm –OH (mỗi nhóm gồm một oxy và một hiđro). Cấu trúc này khiến H₂SO₄ có dạng phân tử tứ diện xung quanh lưu huỳnh, đồng thời giải thích tính axit mạnh của nó khi hai nguyên tử H dễ dàng phân li tạo ion H⁺ trong dung dịch. Sự tồn tại đồng thời của liên kết đôi S=O và nhóm –OH làm cho axit sunfuric có độ bền cao, tính oxi hóa mạnh và khả năng hút nước đặc trưng.
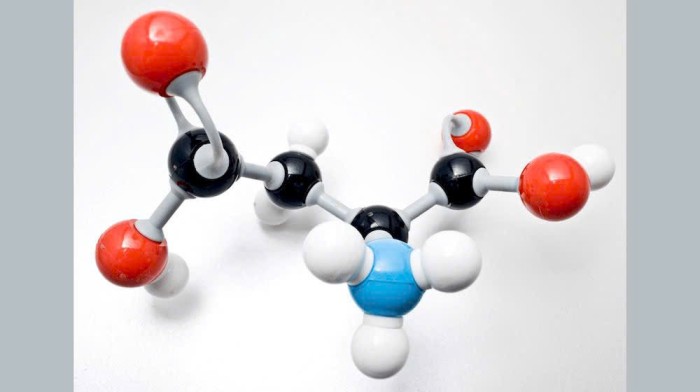
Tính chất vật lý của H₂SO₄
Axit sunfuric (H₂SO₄) là chất lỏng không màu, không mùi, có độ nhớt cao và khả năng hút ẩm rất mạnh. Nó tan vô hạn trong nước và tỏa nhiều nhiệt khi pha loãng, do đó cần rót axit vào nước để tránh bắn văng. H₂SO₄ có khối lượng riêng lớn, điểm sôi cao và tính ăn mòn mạnh, có thể làm than hóa các chất hữu cơ như giấy, đường. Đây là một trong những axit có tính vật lý đặc biệt, dùng rộng rãi trong công nghiệp nhưng cần được bảo quản và sử dụng cẩn thận.

Dưới đây là bảng chi tiết về tính chất vật lý của H₂SO₄:
|
Tính chất |
Thông số và mô tả |
|
Công thức hóa học |
H₂SO₄ |
|
Trạng thái |
Chất lỏng |
|
Màu sắc |
Không màu, sánh |
|
Mùi |
Không mùi |
|
Khối lượng riêng |
~1,84 g/cm³ (ở 20°C) |
|
Nhiệt độ nóng chảy |
10°C |
|
Độ sôi |
337°C |
|
Độ tan |
Tan vô hạn trong nước, tỏa nhiệt mạnh khi hòa tan |
|
Tính hút ẩm |
Rất mạnh (háo nước) |
|
Tính ăn mòn |
Ăn mòn mạnh kim loại và mô sinh học |
|
Tính dẫn điện |
Dẫn điện khi tan trong nước (do phân ly ion) |
Tính chất hóa học của H₂SO₄
Axit sunfuric (H₂SO₄) là một axit mạnh có nhiều tính chất hóa học đặc trưng, thể hiện cả tính axit mạnh, tính oxi hóa mạnh (đối với H₂SO₄ đặc) và tính háo nước. Trong dung dịch, H₂SO₄ phân li mạnh tạo ion H⁺, dễ dàng phản ứng với kim loại, bazơ, oxit bazơ và muối. Ở trạng thái đặc, nó vừa là chất oxi hóa mạnh vừa có khả năng rút nước từ các chất hữu cơ, dẫn đến hiện tượng than hóa đường, giấy, gỗ… Nhờ các tính chất này, H₂SO₄ được sử dụng rộng rãi trong công nghiệp hóa chất, luyện kim, sản xuất phân bón và xử lý kim loại.

Dưới đây là bảng chi tiết về tính chất hóa học của H₂SO₄:
|
Nhóm tính chất |
Mô tả |
Ví dụ phản ứng và hi chú |
|
Tính axit mạnh |
Phân li tạo H⁺, phản ứng với kim loại hoạt động |
Zn + H₂SO₄ → ZnSO₄ + H₂ ↑ |
|
Phản ứng với bazơ |
H₂SO₄ + 2NaOH → Na₂SO₄ + 2H₂O |
|
|
Phản ứng với oxit bazơ |
H₂SO₄ + CuO → CuSO₄ + H₂O |
|
|
Phản ứng với muối |
H₂SO₄ + BaCl₂ → BaSO₄↓ + 2HCl |
|
|
Tính oxi hóa mạnh (H₂SO₄ đặc) |
Oxi hóa kim loại kém hoạt động (Cu, Ag,…) |
Cu + 2H₂SO₄(đ) → CuSO₄ + SO₂ ↑ + 2H₂O |
|
Oxi hóa phi kim |
C + 2H₂SO₄(đ) → CO₂ ↑ + 2SO₂ ↑ + 2H₂O |
|
|
Tính háo nước |
Hút nước, làm than hóa chất hữu cơ |
C₁₂H₂₂O₁₁ (đường) → 12C + H₂O (bị rút nước) |
|
Tính điện li mạnh |
Dẫn điện khi tan trong nước |
Do phân li thành H⁺ và SO₄²⁻ |
Ứng dụng của H₂SO₄ trong đời sống và công nghiệp
- Sản xuất phân bón hóa học (super photphat, amoni sunfat) giúp tăng năng suất cây trồng
- Là dung dịch điện ly trong ắc quy chì–axit của xe máy, ô tô và các thiết bị lưu trữ năng lượng
- Tẩy rửa, làm sạch bề mặt kim loại trong luyện kim trước khi mạ, hàn hoặc sơn
- Nguyên liệu điều chế các hóa chất quan trọng như HCl, HNO₃, Na₂SO₄, trồng,…
- Dùng trong tinh chế và xử lý dầu mỏ, cải thiện chất lượng nhiên liệu
- Sản xuất chất tẩy rửa, hóa chất tẩy trắng, thuốc nhuộm và hỗ trợ xử lý vải sợi
- Tham gia sản xuất giấy, xử lý cellulose, tẩy mực và làm sạch sợi
- Xử lý nước thải, điều chỉnh pH và kết tủa kim loại nặng
- Dùng trong phòng thí nghiệm và giáo dục làm chất điện ly, thuốc thử và xúc tác
Lưu ý an toàn khi dùng H₂SO₄
- Đeo đầy đủ đồ bảo hộ: găng tay, kính, khẩu trang, áo bảo hộ
- Tránh để axit tiếp xúc với da, mắt; nếu dính phải rửa ngay bằng nước sạch
- Tuân thủ quy tắc “rót axit vào nước”, không làm ngược lại
- Làm việc ở nơi thông thoáng, tránh hít hơi axit
- Bảo quản trong chai chuyên dụng, nắp kín, tránh nhiệt và ánh nắng
- Không dùng dụng cụ kim loại thường, ưu tiên thủy tinh/nhựa chịu axit
- Nếu tràn đổ, dùng chất trung hòa như NaHCO₃ rồi thu gom đúng cách
- Tránh tiếp xúc với chất hữu cơ và chất dễ cháy
- Đọc kỹ hướng dẫn an toàn hóa chất (MSDS) trước khi sử dụng
