NaCl là công thức hóa học của natri clorua, thường được biết đến dưới tên gọi quen thuộc là muối ăn. Đây là một hợp chất ion hình thành từ hai nguyên tố: natri (Na) và clor (Cl). Trong tự nhiên, natri clorua tồn tại chủ yếu trong nước biển và các mỏ muối. Đây là một khoáng chất thiết yếu không chỉ đối với cơ thể con người mà còn trong nhiều lĩnh vực của đời sống và sản xuất công nghiệp.
Cấu trúc của Natri Clorua
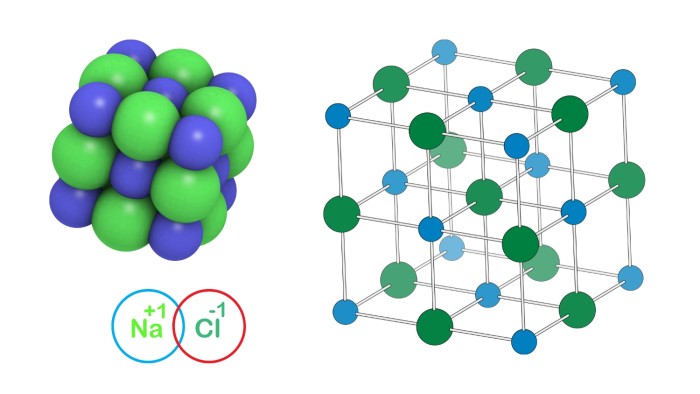
Natri Clorua (NaCl) là một hợp chất ion được hình thành từ hai nguyên tố: natri (Na⁺) và clorua (Cl⁻). Trong tinh thể NaCl, các ion này liên kết với nhau bằng lực hút tĩnh điện, lực hút giữa ion dương và ion âm.
Cấu trúc tinh thể của NaCl là cấu trúc lập phương tâm diện
- Mỗi ion Na⁺ được bao quanh bởi 6 ion Cl⁻ ở khoảng cách bằng nhau, và ngược lại.
- Sự sắp xếp này tạo ra một mạng tinh thể ổn định, chặt chẽ, khiến cho NaCl có nhiệt độ nóng chảy cao và khó bị phá vỡ.
Đặc điểm cấu trúc
- Tỉ lệ Na⁺ : Cl⁻ = 1:1, đúng với công thức hóa học.
- Góc liên kết giữa các ion là 90°, phản ánh cấu trúc hình học lập phương hoàn chỉnh.
- Dạng tinh thể này giúp NaCl tan tốt trong nước, vì các phân tử nước dễ dàng phá vỡ liên kết ion trong mạng tinh thể và hòa tan các ion riêng lẻ vào dung dịch.
Tính chất của Natri Clorua
Tính chất vật lý của NaCl
|
Trạng thái |
Ở điều kiện thường, NaCl là chất rắn dạng tinh thể không màu hoặc màu trắng, có vị mặn đặc trưng. |
|
Cấu trúc tinh thể |
Natri clorua có cấu trúc tinh thể lập phương, trong đó các ion natri và clorua được sắp xếp xen kẽ nhau theo quy luật chặt chẽ. |
|
Nhiệt độ nóng chảy |
Rất cao, khoảng 801°C. |
|
Nhiệt đô sôi |
Khoảng 1413°C. |
|
Tính tan |
Rất dễ tan trong nước, tạo thành dung dịch điện ly có khả năng dẫn điện. |
|
Tính dẫn điện |
NaCl ở dạng rắn không dẫn điện, nhưng khi hòa tan trong nước hoặc nóng chảy, nó phân ly thành ion Na⁺ và Cl⁻ và dẫn điện rất tốt. |
Tính chất hóa học của NaCl
|
Phản ứng |
Phương trình minh họa |
Giải thích |
|
Phản ứng với axit mạnh (H₂SO₄ đặc) |
NaCl + H₂SO₄ → NaHSO₄ + HCl↑ |
Tạo khí HCl – phản ứng đặc trưng dùng trong phòng thí nghiệm để điều chế HCl khí. |
|
Phản ứng điện phân (NaCl nóng chảy) |
2NaCl (l) → 2Na (l) + Cl₂ (g) |
Sản xuất natri kim loại và khí clo, thường áp dụng trong công nghiệp. |
|
Phản ứng điện phân dung dịch NaCl |
2NaCl + 2H₂O → 2NaOH + H₂ + Cl₂ |
Dùng trong công nghiệp sản xuất xút (NaOH), clo và hydro. |
|
Phản ứng trao đổi trong dung dịch |
NaCl + AgNO₃ → AgCl↓ + NaNO₃ |
Phản ứng tạo kết tủa AgCl màu trắng, dùng để nhận biết ion Cl⁻. |
|
Phản ứng với bazơ mạnh không xảy ra |
— |
NaCl là muối của axit mạnh và bazơ mạnh nên không phản ứng với kiềm trong điều kiện thường. |
Cách sản xuất và điều chế muối NaCl

- Từ các mỏ muối đá trong lòng đất, đây là nguồn cung cấp muối ăn tự nhiên lâu đời.
- Phương pháp truyền thống phổ biến nhất ở các nước ven biển. Nước biển được dẫn vào các ruộng muối, qua quá trình bốc hơi dưới ánh nắng mặt trời sẽ kết tinh ra muối.
- Điện phân nước muối để thu được clo, hydro và natri hydroxit.
- Sản xuất NaCl từ các dung dịch chứa clorua trong công nghiệp hóa chất.
Ứng dụng của Natri Clorua
Trong sản xuất công nghiệp
- Nguyên liệu sản xuất xút (NaOH), clo (Cl₂) và hydro (H₂) thông qua quá trình điện phân nước muối.
- Là chất làm mềm nước, giúp loại bỏ ion canxi và magie gây cứng nước.
- Ứng dụng trong sản xuất thủy tinh, chất tẩy rửa, phẩm nhuộm và nhiều loại hóa chất khác.
- Làm chất bảo quản da, trong công nghiệp thuộc da.
Ứng dụng trong thực phẩm

- Là gia vị không thể thiếu trong mọi căn bếp, giúp tăng hương vị món ăn.
- Bảo quản thực phẩm: Ức chế sự phát triển của vi sinh vật, đặc biệt là trong muối dưa, làm mắm, cá khô, thịt muối…
- Hỗ trợ quá trình lên men trong làm bánh mì, phô mai và các sản phẩm chế biến khác.
Xử lý nước bể bơi
- Natri clorua được sử dụng trong hệ thống chlorinator, thiết bị tạo clo từ muối thông qua điện phân, giúp tiêu diệt vi khuẩn và rong rêu trong nước mà không cần dùng clo hóa chất dạng viên.
- Giảm thiểu mùi clo, không gây kích ứng da hoặc mắt như các phương pháp xử lý hóa chất truyền thống.
Ứng dụng trong y tế, sức khỏe

- NaCl ở nồng độ 0.9% là thành phần của nước muối sinh lý, dùng để rửa vết thương, súc miệng, rửa mắt, pha thuốc tiêm truyền.
- Dùng làm dung dịch bù nước và điện giải cho cơ thể trong điều trị mất nước.
- Ứng dụng trong một số sản phẩm xông mũi, làm sạch xoang, khử trùng.
Ứng dụng của muối trong đời sống gia đình
- Rửa bồn rửa chén, lau chùi tủ lạnh, bình pha cà phê…
- Muối giữ cho trái cây không bị thâm, khử mùi hôi của tỏi, bảo vệ mặt đáy của bếp nướng…
- Có thể sử dụng muối để tẩy vết rượu vang, vết bẩn do mồ hôi, làm sạch bàn ủi quần áo…
NaCl (hay muối ăn) không chỉ là một hợp chất hóa học đơn giản mà còn là nguyên liệu thiết yếu trong đời sống hàng ngày và nhiều ngành công nghiệp quan trọng. Với đặc tính vật lý và hóa học đặc biệt, cùng khả năng ứng dụng rộng rãi từ thực phẩm, y tế đến xử lý nước và làm sạch, natri clorua đã và đang khẳng định vai trò không thể thay thế trong cuộc sống hiện đại. Việc hiểu rõ về đặc điểm, ứng dụng và cách sử dụng NaCl sẽ giúp chúng ta khai thác tối đa giá trị của nó một cách an toàn và hiệu quả.
