Nitrogen dioxide (NO₂) là một khí độc, màu nâu đỏ, có mùi hắc và rất dễ nhận biết bằng mắt thường nhờ màu đặc trưng. NO₂ thuộc nhóm oxit của nitơ, là thành phần quan trọng trong ô nhiễm không khí và sương mù quang hóa.

NO₂ có nguồn gốc từ đâu?
Nguồn tự nhiên
- Phóng điện trong không khí khi có sấm sét.
- Các hoạt động núi lửa.
- Quá trình phân hủy tự nhiên của chất hữu cơ trong môi trường.
Nguồn nhân tạo
- Đốt nhiên liệu hóa thạch (than đá, dầu diesel, xăng).
- Khí thải giao thông từ xe máy, ô tô, xe tải.
- Các nhà máy nhiệt điện, luyện kim, nhà máy hóa chất.
- Từ việc đốt rơm rạ, chất thải hoặc cháy rừng.
Tính chất lý hóa của NO₂
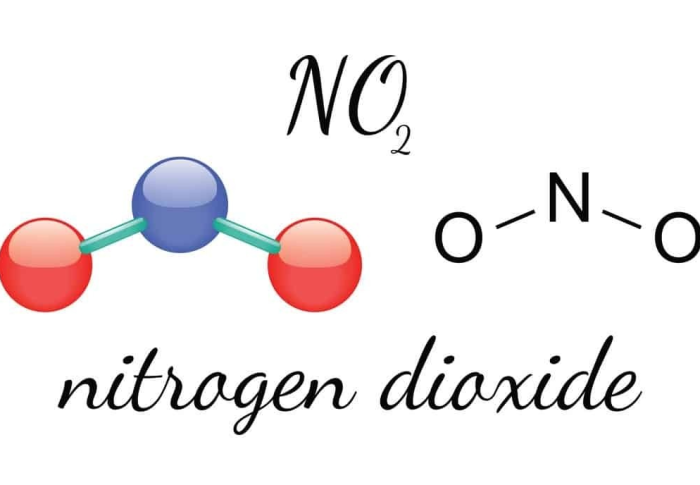
Tính chất vật lý
- Khí màu nâu đỏ đặc trưng, mùi hăng khó chịu.
- Nặng hơn không khí, dễ tích tụ ở tầng thấp.
- Dễ hóa lỏng, khi hóa lỏng sẽ tạo thành chất màu vàng nâu sẫm.
- Tan hạn chế trong nước, nhưng khi tan sẽ tham gia phản ứng hóa học.
- Có khả năng tồn tại ở dạng cân bằng với khí N₂O₄ (không màu), tùy theo nhiệt độ.
Tính chất hóa học
|
Tính chất |
Mô tả chi tiết |
|
Tính oxy hóa mạnh |
NO₂ có khả năng oxy hóa nhiều kim loại và hợp chất vô cơ, hữu cơ trong điều kiện khác nhau. |
|
Tác dụng với nước |
Tan hạn chế trong nước nhưng khi tan sẽ tạo hỗn hợp axit nitric (HNO₃) và axit nitrous (HNO₂). |
|
Tác dụng với kiềm |
Tạo muối nitrat và nitrit khi phản ứng với dung dịch kiềm. |
|
Tác dụng với kim loại |
Nhiều kim loại bị oxy hóa khi tiếp xúc với NO₂, tạo thành muối nitrat. |
|
Liên hệ cân bằng với N₂O₄ |
NO₂ tồn tại trong cân bằng với N₂O₄ (không màu) ở nhiệt độ thấp → N₂O₄; ở nhiệt độ cao → NO₂. |
|
Tham gia phản ứng quang hóa |
Khi có ánh sáng mặt trời, NO₂ tham gia hình thành ozone tầng thấp và sương mù quang hóa. |
Ứng dụng của NO₂ trong đời sống và công nghiệp

- Tham gia sản xuất axit nitric trong công nghiệp hóa chất.
- Là chất oxy hóa mạnh dùng trong tên lửa và động cơ phản lực.
- Ứng dụng trong quá trình tẩy trắng bột giấy, nhưng cần kiểm soát nghiêm ngặt.
- Dùng trong phân tích hóa học để xác định thành phần của kim loại hoặc khoáng chất.
Tác hại của NO₂
Đối với sức khỏe con người
- Gây kích ứng mạnh đường hô hấp, dẫn đến ho, khó thở.
- Làm tổn thương phổi, giảm chức năng phổi và tăng nguy cơ viêm phế quản, hen suyễn.
- Tiếp xúc lâu dài có thể làm suy giảm hệ miễn dịch.
- Nồng độ cao có thể gây phù phổi cấp và tử vong.
Đối với môi trường
- Góp phần tạo mưa axit, gây ăn mòn kim loại, hư hại công trình.
- Tạo ozone tầng thấp và sương mù quang hóa.
- Làm giảm chất lượng không khí và tăng hiệu ứng nhà kính.
Đối với sinh vật

- Ảnh hưởng trực tiếp đến hệ hô hấp của động vật.
- Làm suy yếu hệ sinh thái nước khi gây mưa axit làm giảm pH.
- Gây tổn thương lá cây, giảm khả năng quang hợp, làm suy giảm năng suất mùa màng.
Một số biểu hiện và cách xử lý khi nhiểm độc NO₂
Biểu hiện khi nhiễm độc NO₂
- Khó thở, ho, đau tức ngực.
- Cảm giác nhoi nhói tại họng, rát mũi và cay mắt.
- Dễ nhầm với các bệnh về đường hô hấp nên có thể không xử lý kịp thời.
- Sau đó, nitrite trong cơ thể oxy hóa hemoglobin thành methemoglobin khiến máu mất khả năng vận chuyển oxy.
- Tạo methemoglobiamin, hợp chất ngăn chặn sự gắn kết oxy, gây thiếu oxy nghiêm trọng.
- Mệt mỏi, chóng mặt, tím tái, suy hô hấp.
- Nặng hơn có thể dẫn đến phù phổi cấp, mất ý thức hoặc tử vong.

Cách xử lý
- Đưa nạn nhân ra khỏi khu vực có NO₂ ngay lập tức, đến nơi thoáng khí.
- Nới lỏng quần áo, giữ nạn nhân nằm yên và thở trong không khí sạch.
- Gọi cấp cứu càng sớm càng tốt.
- Nếu có, cung cấp oxy y tế để hỗ trợ hô hấp.
- Tuyệt đối không tự ý dùng thuốc khi chưa có hướng dẫn của bác sĩ.
- Người nghi ngờ nhiễm độc cần được theo dõi 24 – 48 giờ vì triệu chứng phù phổi có thể xuất hiện muộn.
NO₂ là khí độc phổ biến trong môi trường đô thị và công nghiệp, gây ảnh hưởng nghiêm trọng đến sức khỏe con người, môi trường và các hệ sinh thái. Hiểu rõ tính chất, nguồn phát sinh và tác hại của NO₂ giúp chúng ta chủ động phòng ngừa, giảm thiểu tiếp xúc và bảo vệ sức khỏe. Việc giám sát chất lượng không khí, hạn chế đốt nhiên liệu và sử dụng thiết bị lọc khí là những giải pháp cần thiết để giảm ô nhiễm NO₂ trong cuộc sống hiện đại.
