HCl (axit clohidric) là dung dịch được tạo ra khi khí hidro clorua (HCl) hoà tan hoàn toàn vào nước. Đây là một loại axit vô cơ, không màu (hoặc hơi vàng nhạt nếu bị tạp chất), có mùi rất hăng và dễ bay hơi. HCl được sử dụng rộng rãi trong công nghiệp, phòng thí nghiệm, xử lý kim loại, chế biến thực phẩm và xử lý nước thải.

HCl là axit mạnh hay yếu?
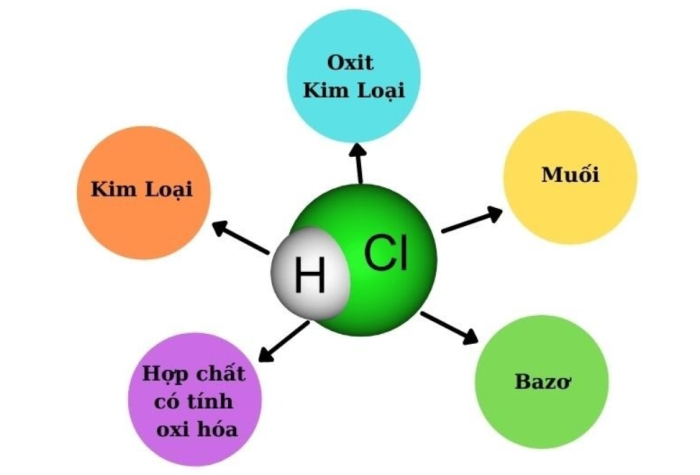
HCl là axit vô cơ cực mạnh, có khả năng điện ly hoàn toàn trong nước. Vì vậy mang đầy đủ tính chất của axit mạnh.
- Làm quỳ tím chuyển sang màu đỏ.
- Phản ứng mạnh với kim loại tạo ra muối clorua + khí H₂.
- Tác dụng với oxit kim loại → muối + nước.
- Tác dụng với bazơ / dung dịch kiềm → muối + nước.
- Tác dụng với muối để tạo muối mới + axit mới.
Axit clohidric có độc không?

Mức độ nguy hiểm của HCl phụ thuộc vào nồng độ và dạng tiếp xúc.
|
Dạng tiếp xúc |
Mức độ nguy hiểm |
|
Khí HCl |
Gây bỏng đường hô hấp, cay mắt, khó thở, có thể gây phù phổi |
|
HCl dạng lỏng |
Bỏng da nghiêm trọng, gây ăn mòn mô rất nhanh |
|
Tiếp xúc lâu dài |
Tổn thương hệ hô hấp mãn tính, gây viêm da mãn tính |
Ứng dụng của axit clohidric

- Tẩy gỉ kim loại trước khi mạ hoặc hàn.
- Điều chỉnh pH trong sản xuất và xử lý nước thải.
- Sản xuất PVC, phân bón, thuốc nhuộm.
- Chế biến thực phẩm (tinh luyện đường, sản xuất gelatin).
- Dùng trong phân tích thí nghiệm hóa học.
Tính chất của axit clohidric
|
Nhóm tính chất |
Tính chất |
|
Tính chất vật lý |
- Dung dịch không màu, có mùi xốc, tan vô hạn trong nước - Tỷ khối lớn hơn nước (nồng độ đậm đặc ~37–38%) - Có tính ăn mòn mạnh, dễ bay hơi tạo khói trắng trong không khí ẩm |
|
Tính chất hóa học chung |
- Là axit mạnh, phân ly hoàn toàn trong nước: HCl → H⁺ + Cl⁻ - Làm quỳ tím hóa đỏ, phản ứng với bazơ, oxit bazơ và muối ⇒ tạo muối clorua |
|
Tính khử |
- Có thể khử một số chất oxi hóa mạnh như KMnO₄, K₂Cr₂O₇ (trong môi trường axit) - HCl + KMnO₄ → MnCl₂ + Cl₂ + ... (giải phóng khí clo) |
|
Tác dụng với kim loại |
Phản ứng với nhiều kim loại đứng trước H trong dãy hoạt động → tạo muối clorua + khí H₂ (Ví dụ: Fe + 2HCl → FeCl₂ + H₂↑) |
|
Tác dụng với oxit bazơ |
Tạo muối + nước (Ví dụ: CuO + 2HCl → CuCl₂ + H₂O) |
|
Tác dụng với muối |
Đẩy axit yếu hơn ra khỏi muối của nó (Ví dụ: Na₂CO₃ + 2HCl → 2NaCl + CO₂ + H₂O) |
|
Tác hại – an toàn |
- Gây bỏng hóa chất nghiêm trọng nếu dính da/mắt - Khí HCl gây hại hệ hô hấp - Cần bảo hộ nghiêm ngặt khi sử dụng |
Những lưu ý khi sử dụng và bảo quản axit clohidric

- Luôn dùng găng tay, kính bảo hộ, khẩu trang.
- Không để gần kim loại dễ bị ăn mòn.
- Bảo quản trong chai nhựa hoặc thủy tinh chuyên dụng, đậy kín.
- Tránh nơi có nhiệt độ cao, ẩm dễ bay hơi, tạo khí độc.
- Không đổ trực tiếp vào nước → phải rót axit từ từ vào nước.
HCl là một axit vô cơ cực mạnh, giữ vai trò quan trọng trong sản xuất công nghiệp và phòng thí nghiệm. Tuy nhiên, do tính ăn mòn và độc tính cao, việc sử dụng và bảo quản HCl cần tuân thủ nghiêm ngặt các quy tắc an toàn.
